Las bacterias del género Streptomyces son habitantes del suelo capaces de producir un número muy elevado de compuestos, generalmente no esenciales para la supervivencia de la cepa, que se denominan metabolitos secundarios. Estos incluyen más del 65% de los antibióticos conocidos, con actividad antifúngica, antibacteriana, o antiviral, pero también compuestos antitumorales, anticolesterolémicos, inmunosupresores, neuroprotectores, compuestos con actividad insecticida o antihelmíntica, y metabolitos secundarios adicionales como pigmentos, sideróforos, hopanoides, terpenos, y butirolactonas o péptidos implicados en la diferenciación morfológica o la comunicación bioquímica entre células. Este enorme arsenal biosintético convierte a estas bacterias en el principal reservorio biológico de productos naturales bioactivos de interés farmacológico y/o industrial.
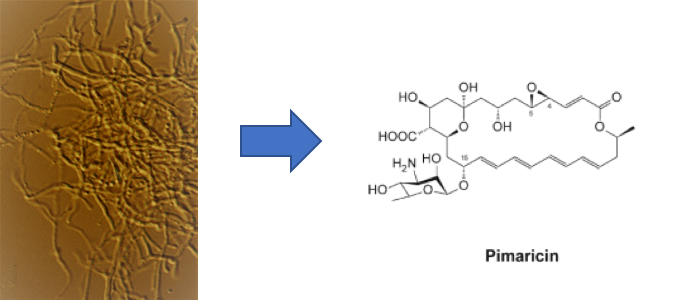
Fig. 1. Micelio de Streptomyces natalensis y estructura del antifúngico pimaricina que produce.
A pesar del gran número de fármacos disponibles en la actualidad existe una creciente y urgente necesidad de nuevos compuestos bioactivos para hacer frente a la aparición de cepas resistentes, nuevas enfermedades infecciosas, mejorar la biodisponibilidad de los compuestos actualmente en uso, o disminuir los efectos secundarios de los tratamientos actuales. Esto se une al problema de que en las últimas décadas se ha producido un freno preocupante en el descubrimiento de nuevos fármacos, hecho que queda reflejado por el descubrimiento de la teixobactina en 2015, siendo el único antibiótico nuevo descubierto en los últimos 30 años. La estrategia clásica de búsqueda de compuestos bioactivos mediante programas de screening de productos naturales ya no es efectiva, ya que se aíslan compuestos con estructuras ya conocidas, lo que se ha unido a la menor inversión de las compañías farmacéuticas en estos programas de búsqueda de compuestos, por lo que es necesario desarrollar nuevas estrategias.
El desarrollo y abaratamiento de los sistemas de secuenciación masiva ha permitido la secuenciación completa de un gran número de genomas de bacterias del género, lo que unido al desarrollo de programas bioinformáticos de búsqueda y predicción de agrupaciones génicas de biosíntesis metabolitos secundarios, ha desvelado un elevado número de agrupaciones génicas para metabolitos previamente identificados pero cuya genética y regulación eran desconocidas. Pero también algo mucho más trascendental, como es el hecho de que el genoma contenga información para la biosíntesis de un número muy elevado de compuestos que nunca previamente habían sido identificados. Así, mientras una cepa de Streptomyces determinada produce unos 3-4 metabolitos conocidos, el número medio de clusters de metabolitos secundarios presentes en su genoma es de 20-30 o más. Por lo tanto, el potencial biosintético de estas bacterias ha sido enormemente infravalorado.
Estas agrupaciones génicas (denominadas crípticas) no se expresan o lo hacen a niveles muy bajos en condiciones normales de laboratorio (son también durmientes). La expresión de una agrupación génica de un metabolito secundario dado depende de una serie de señales (controles) medioambientales y está mediada por complejas cascadas de regulación. Quizás por este motivo, estos clusters son frecuentemente silentes en condiciones normales de laboratorio, dado que en las mismas no están presentes los “interruptores” ecológicos apropiados. Estas agrupaciones “silenciosas” han sido descubiertas mediante “genome-mining” o por estudios bioinformáticos de los genes presentes en los genomas, y puesto que la expresión de las mismas puede conducir a la producción de compuestos bioactivos totalmente nuevos, existe un enorme interés en encontrar mecanismos para activarlas.
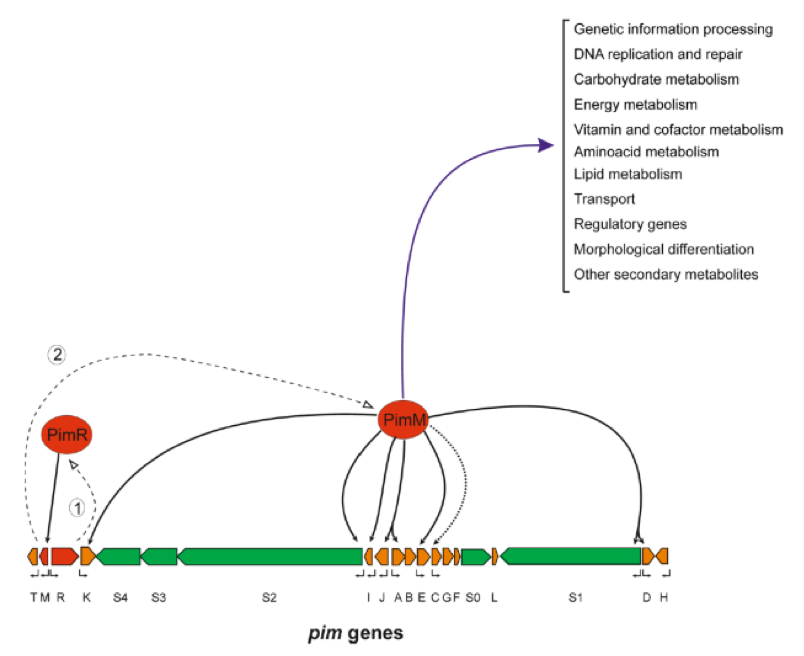
Fig. 2. Modelo de regulación de la producción de pimaricina llevada a cabo por los reguladores PimR y PimM. Las líneas discontinuas indican transcripción y traducción. Las líneas negras continuas indican activación transcripcional directa, la punteada activación indirecta, y la azul otros procesos afectados por PimM.
Desde hace años hemos estudiado distintos mecanismos de control de la producción de metabolitos secundarios (ver listado de publicaciones sobre regulación del metabolismo secundario). Se trata de redes en la que distintos reguladores, a veces en número muy elevado, interaccionan entre sí para modular la producción de un determinado compuesto. El conocimiento de estas redes reguladoras, y de las señales que disparan su expresión, es esencial para optimizar la producción de un metabolito secundario en particular, pero también para poder activar la expresión de compuestos que de otro modo permanecerían “ocultos”.
